Цитофлавин ребенку 2 года

Комментарии
Опубликовано в журнале:
Журнал неврологии и психиатрии, 10, 2016
doi: 10.17116/jnevro201611610134-37
С.Ю. Лаврик1*, В.В. Шпрах2, С.В. Домитрак1, А.С. Борисов1
1 Клиника ГБОУ ВПО «Иркутский государственный медицинский университет», Иркутск, Россия; 2 ГБОУ ДПО «Иркутская государственная медицинская академия последипломного образования», Иркутск, Россия
Цель исследования. Изучение эффективности и безопасности комплексного метаболического нейропротектора цитофлавина у детей с последствиями перинатального гипоксического поражения ЦНС. Материал и методы. Монотерапия цитофлавином проводилась в течение 25 дней по 1 таблетке 2 раза в день в трех группах пациентов в возрасте 4—8 лет: с детским церебральным параличом — 35 детей, минимальной мозговой дисфункцией — 64 и сенсоневральной тугоухостью — 47. Контрольную группу составили 30 детей. До назначения цитофлавина и после завершения курса лечения проводили исследование неврологического статуса, нейрофизиологическое обследование и нейропсихофизиологическое тестирование. Результаты и заключение. Установлена эффективность цитофлавина у детей дошкольного и раннего школьного возраста, отмечено комплексное нейропротективное действие препарата, включающее вазоактивный, ноотропный и противоастенический эффекты. Побочных реакций на фоне приема препарата не наблюдалось.
Ключевые слова: детский церебральный паралич, сенсоневральная тугоухость, минимальная мозговая дисфункция, нейропсихофизиологическое тестирование, цитофлавин.
Cytoflavin in the treatment of preschool and early school age children with the consequences of perinatal hypoxic brain damages
S.Yu. Lavrick, V.V. Shprakh, S.V. Domitrak, A.S. Borisov
Clinic of Nervous Diseases of Irkutsk State Medical University, Irkutsk, Russia; Irkutsk State Medical Academy of Continuing Education, Irkutsk, Russia
Objective. To study the efficacy and safety of the complex metabolic neuroprotector cytoflavin in children with the consequences of perinatal hypoxic brain damages. Material and methods. Patients, aged 4—8 years, were stratified into three groups: 35 with infant cerebral palsy, 64 with the minimal brain dysfunction and 47 with sensorineural hearing loss. The control group consisted of 30 children. Monotherapy with cytoflavin was carried out in the dose of one tablet twice a day for 25 days. Neurologic status, neurophysiological examination andneuropsychophysiological testing were performed before and after treatment. Results and conclusion. The efficacy of cytoflavin in children of preschool and early school agewas demonstrated. A complex neuroprotective action, including vasoactive, nootropic and antiasthenic effects, was revealed. Side-effects of cytoflavin were not observed.
Keywords: infant cerebral palsy, sensorineural hearing loss, minimal cerebral dysfunction, neuropsychophysiological testing, cytoflavin.
Перинатальные поражения ЦНС, обусловленные различными факторами риска и их сочетанием, составляют большую гетерогенную группу патологических состояний. Наиболее высок процент таких нарушений среди глубоко недоношенных новорожденных, родившихся в условиях острой и хронической гипоксии, что оказывает крайне неблагоприятное воздействие на развивающийся мозг, имеющий высокую потребность в энергии и глюкозе. Большинство исследователей считают, что после запуска нейротоксического каскада, связанного с гипоксически-ишемическим воздействием, процесс повреждения мозговой ткани может сохраняться длительное время, носить самоподдерживающийся характер за счет патологической возбудимости нейронов и феномена эксайтотоксичности, в связи с чем последствия перинатального поражения (ППП) ЦНС нередко отмечаются и в более отдаленных периодах жизни детей [1—7].
К неблагоприятным вариантам ППП ЦНС большинство авторов [4—7] относят детский церебральный паралич (ДЦП), сенсоневральную тугоухость (СНТ) и минимальную мозговую дисфункцию (ММД). На современном этапе термин ДЦП включает в себя большую группу резидуальных состояний с непрогрессирующим течением, частота которых обусловлена повреждением головного мозга на ранних этапах его развития [1, 2, 6, 7]. С учетом улучшения сурдологической помощи детям, СНТ также представляет собой весьма значимую медико-экономическую проблему: на 1000 новорожденных с нормальным слухом приходится 1 ребенок с выраженной степенью тугоухости, а нарушения слуха средней и легкой степени отмечаются у 1—2% новорожденных [8]. ММД характеризуется нарушением развития отдельных высших психических функций (ВПФ) при отсутствии выраженного снижения интеллекта, в сочетании с расстройствами поведения и эмоциональной сферы, приводящими в случае прогрессирования к социальной дезадаптации ребенка [3, 9—11]. По результатам собственных исследований, частота ММД у детей дошкольного и раннего школьного возраста в среднем составляет 11,9%.
Углубленная нейрофизиологическая и нейропсихофизиологическая диагностика позволяет выработать дифференцированные подходы к лечению и реабилитации детей с ППП ЦНС, являясь одним из перспективных направлений в неврологии детского возраста. Такие дети нуждаются в объективной оценке степени тяжести имеющихся клинических и нейропсихологических синдромов, последующем динамическом наблюдении и своевременном проведении комплекса лечебно-реабилитационных мероприятий, что позволяет оптимизировать темпы психомоторного развития, улучшая неврологический прогноз и социальную адаптацию [1, 2, 5, 6, 10].
Цель исследования — изучение клинико-нейрофизиологических особенностей терапевтического воздействия таблетированной формы цитофлавина, его эффективности и безопасности у детей с различными клиническими вариантами ППП ЦНС.
Материал и методы
Обследованы 176 детей дошкольного (5—6 лет) и раннего школьного (7—8 лет) возраста с различными клиническими вариантами ППП ЦНС: 35 детей с ДЦП, 47 детей с СНТ и 94 ребенка с ММД, 30 из которых вошли в группу контроля. Все группы были сопоставимы по полу и возрасту.
Оценка эффективности цитофлавина проводилась по данным неврологического осмотра, нейрофизиологического обследования, нейропсихофизиологического и речевого тестирования. Нейрофизиологическое обследование включало компьютерную электроэнцефалографию (ЭЭГ), транскраниальную допплерографию (ТКДГ) и компьютерную эхоэнцефалоскопию (Эхо-ЭС) с допплеровским исследованием ликвородинамики. Нейропсихофизиологическое тестирование проводилось с использованием компьютерного комплекса программ Spike-Children v. 2.7, включающих 24 стандартизированных теста, объединенных в 3 блока: нейропсихологический, психофизиологический и речевой. Исследование слухоречевой сферы у детей с СНТ осуществлялось с использованием оригинальной компьютерной программы Speech_Audiometry. Исследования проводились дважды: перед началом лечебно-реабилитационного курса и после его завершения. Пациенты наряду с физическими, физиотерапевтическими и психолого-педагогическими методами реабилитации получали монотерапию цитофлавином (ООО «НТФФ «Полисан», Санкт-Петербург, Россия) по схеме: 1 таблетка 2 раза в день (утром и в обед), ежедневно, на протяжении 25 дней. Всем детям с ММД, вошедшим в группу контроля и не получавшим медикаментозную терапию, проводили стандартный комплекс физических, физиотерапевтических и психолого-педагогических методов реабилитации. Было получено одобрение комитета по этике Иркутской государственной медицинской академии последипломного образования.
Для обработки результатов исследований применяли общепринятые методы вариационной статистики. Оценку достоверности статистических различий проводили параметрическими и непараметрическими методами с помощью критериев Стьюдента, Манна—Уитни, Уилкоксона. Различия считались статистически достоверными при уровне значимости не менее 95%. Расчеты производились на персональном компьютере при помощи пакета программ MS Excel 2010, Биостат, Statisica 6.0.
Результаты и обсуждение
Наиболее распространенными немоторными синдромами при ДЦП явились церебрастенический синдром (85%) и синдром ликвородинамических нарушений (65%), а также синдром вегетативной дистонии (65,2%). В неврологическом статусе детей с СНТ у 72,3% выявлялась рассеянная неврологическая симптоматика в виде оживления глубоких рефлексов, анизорефлексии, недостаточности мелкой моторики; у 65,9% детей наблюдались легкие и умеренные дискоординаторные нарушения. В рамках основного заболевания у всех детей встречалась вторичная задержка речевого развития различной степени выраженности, варианты детских дисфазий, проявления дислексии, дисграфии, реже дискалькулии. Признаки церебрастенического синдрома достоверно чаще (p<0,05) встречались среди детей раннего школьного возраста, что наиболее вероятно могло быть связано с недостаточной адаптацией к школьным нагрузкам.
Характерный для большинства детей с ММД синдром дефицита внимания и гиперактивности регистрировался у 22,9% детей с ДЦП, проявляясь неусидчивостью, недостатком активного внимания, повышенной утомляемостью во время занятий, истощаемостью при игровой деятельности, а также при проведении различных лечебно-реабилитационных мероприятий. При СНТ нарушения поведения отмечались у 80,6%, достоверно чаще (p<0,01) встречаясь в группах детей со средней и тяжелой степенями СНТ. Нарушения сна в виде трудностей засыпания, поверхностного, прерывистого сна и парасомний имелись 27,3% детей с ППП ЦНС. Частота эпилептического синдрома при ДЦП в среднем составила 13,5%, при СНТ коморбидность с эпилепсией отмечалась в единичных случаях, и только при ММД выявление эпилептогенных механизмов являлось критерием исключения из данной нозологической группы.
Комплексная нейропротективная терапия у детей с ППП ЦНС направлена на уменьшение выраженности двигательных нарушений, коррекцию эмоциональных и поведенческих расстройств, нормализацию уровня мозгового кровотока и ликвородинамики, улучшение обменных процессов в ткани мозга, а также стимулирование развития ВПФ. Так, на фоне лечения цитофлавином у детей с ДЦП достоверно (p<0,01) уменьшилась выраженность парезов: увеличился объем активных движений, снизилась спастичность мышечных групп. Было отмечено уменьшение дискоординаторных расстройств, достоверно (p<0,05) чаще имевших место у детей с двойной гемиплегией и атонически-астатической формой.
Большое значение у детей с ППП ЦНС имели количественная оценка состояния ВПФ в процессе реабилитации, составление нейропсихофизиологического профиля ребенка в динамике.
На фоне лечения цитофлавином отмечалось достоверное улучшение результатов нейропсихофизиологических тестов — повторения фраз, ритмов, вербальной слуховой памяти и минимальной скорости простой сенсомоторной реакции в группе детей с ДЦП (p<0,05). У детей с СНТ отмечено достоверное улучшение звукопроизношения и разборчивости речи, повышение концентрации и устойчивости внимания в теппинг-тесте, по данным сенсомоторных реакций выявлено улучшение средней скорости реакции, уменьшение количества ошибок (p<0,05). В группе детей с ММД было отмечено достоверное (p≤0,05) улучшение речи, праксиса, гнозиса, отчетливое повышение концентрации и устойчивости как поддерживаемого, так и избирательного внимания в сравнении с детьми контрольной группы, а также значимое (p<0,01) увеличение объема вербальной слуховой памяти.
При сравнении с возрастными нормативами в фоновой записи ЭЭГ у большинства детей с ППП ЦНС отмечалось усиление процессов синхронизации и преобладание мощности медленноволновой части спектра, что можно соотнести с ослаблением корковых влияний и доминированием неспецифических подкорковых структур. На фоне терапии цитофлавином при ММД было зафиксировано достоверное повышение индекса α-ритма — с 8,7±5,1 до 13,6±4,7, p<0,05; при СНТ — с 5,1±2,1 до 8,2±4,4, p<0,05; при ДЦП достоверное повышение индекса α-ритма наблюдалось только при двойной гемиплегии (с 2,2±2,4 до 6±4,5, p<0,05). Таким образом, в целом у детей с ППП ЦНС отмечалась устойчивая тенденция к снижению количества и амплитуды Δ-колебаний, повышению индекса α-ритма.
Анализ уровня мозгового кровотока у детей с ДЦП до лечения цитофлавином выявил значительное его снижение в передних отделах головного мозга. Например, средняя линейная скорость кровотока (ЛСК) в русле передней мозговой артерии (ПМА) при различных формах ДЦП в среднем составила 7,9±3,9 см/с при возрастной норме 71±5 см/с [12]; средняя ЛСК в русле средней мозговой артерии (СМА) составила 22,6±10,9 см/с при норме 97±9 см/с; при этом в задней мозговой артерии (ЗМА) кровоток был снижен в меньшей степени, а в некоторых случаях был нормальным и даже повышенным (см. таблицу). Сохранность кровотока, а иногда его повышение в вертебрально-базилярной системе у детей со спастическими формами ДЦП можно расценивать как механизм компенсации выраженной гипоперфузии в каротидном бассейне. В норме средняя ЛСК в русле ЗМА равна 57±9 см/с [12] (см. таблицу).
Сравнительные данные ТКДГ у детей с ППП ЦНС до и после лечения цитофлавином (M±m)

Примечание. p1 — различия в группе детей с ДЦП до и после лечения цитофлавином; p2 — различия в группе детей с СНТ до и после лечения цитофлавином; p3 — различия в группе детей с ММД до и после лечения цитофлавином; p4 — различия в группе детей с ММД в сравнении с группой контроля.
Существенную роль в формировании и персистировании механизмов церебральной гипоперфузии у детей с ППП ЦНС играют вазоспастические реакции в микроциркуляторном русле. Так, у детей с ДЦП индекс Пурсело (RI), отражающий тонус сосудов и периферическое сосудистое сопротивление, в каротидном бассейне был значительно повышен (0,8±0,2—0,9±0,1 при норме 0,5—0,7), а в русле ЗМА RI был в пределах нормы (0,6±0,1).
У большинства детей с СНТ выявлено умеренное диффузное снижение церебрального кровотока (в среднем на 30—40% от возрастных нормативов), при этом обращало внимание существенное повышение RI в каротидном бассейне, однако в русле ЗМА гипоперфузия нередко сочеталась с нормальными показателями RI (0,6±0,2).
При ММД достоверное (p<0,05) негрубое снижение церебрального кровотока (в среднем на 20—25% от возрастных нормативов) отмечалось в русле ПМА и ЗМА при достаточно сохранных показателях кровотока в русле СМА. Как и при других формах ППП ЦНС, при ММД наблюдалась тенденция к повышению сосудистого тонуса в каротидном бассейне, но достоверно в меньшей степени (RI=0,8±0,6, p<0,05).
На фоне лечения цитофлавином во всех исследуемых группах достоверно нарастала средняя ЛСК (p<0,05), преимущественно в каротидном бассейне (см. таблицу). Так, средняя ЛСК максимально повысилась в группах детей с ДЦП и СНТ (в каротидном бассейне — на 80—85 и 40—45% соответственно), тогда как в группе детей с ММД данное повышение составило только 5—15% от исходных значений. Уменьшение признаков гипоперфузии, как правило, сопровождалось снижением либо нормализацией RI. Увеличение средней ЛСК в русле ЗМА было достоверным только в группах детей с СНТ и ММД (p<0,05), при этом препарат не оказывал существенного влияния на исходно нормальные показатели RI.
Таким образом, у детей дошкольного и младшего школьного возраста с ППП ЦНС цитофлавин оказывает нормализующее действие на основные показатели церебральной гемодинамики, главным образом за счет уменьшения вазоспастических реакций и повышения уровня мозгового кровотока, в большей степени — в каротидном бассейне. К основным преимуществам применения цитофлавина у детей с ППП ЦНС можно отнести нормализующее влияние на церебральный кровоток, а также на отчетливое ноотропное и противоастеническое действия. Учитывая простоту применения препарата, доказанную клиническую эффективность и безопасность, таблетированная форма цитофлавина может быть рекомендована для курсовой терапии детей дошкольного и младшего школьного возраста с ППП ЦНС.
Конфликт интересов отсутствует.
Литература
- Детская неврология. Клинические рекомендации. Под ред. В.И. Гузевой. М.: МК; 2014.
- Немкова С.А. Детский церебральный паралич: диагностика и коррекция когнитивных нарушений. М.: Союз педиатров России; 2012.
- Скворцов И.А. Неврология развития. М.: Литтерра; 2008.
- Классификация перинатальных поражений нервной системы и их последствий у детей первого года жизни. Методические рекомендации. Под ред. Н.Н. Володина. М.: ВУНМЦ; 2006.
- Пальчик А.Б., Шабалов Н.П. Гипоксически-ишемическая энцефалопатия новорожденных. М.: МЕДпресс-информ; 2006.
- Петрухин А.С. Неврология детского возраста. М.: Медицина; 2004.
- Volpe J. Neurology of Newborn. NY.: Ch. L.; 2002.
- Breneman AI, Gifford RH, Dejong MD. Cochlear Implantation in Children with Auditory Neuropathy Spectrum Disorder: Long Term Outcomes. Journal of the American Academy of Audiology. 2012;23(1):5-17.
doi: 10.3766/jaaa.23.1.2 - Zavadenko NN, Simashkova NV. New Approaches to the Diagnosis of Attention Deficit Hyperactivity Disorder. Neuroscience and Behavioral Physiology. 2015;45(7):837-842.
doi: 10.1007/s11055-015-0152-2 - Bhutta AT, Cleves MA, Casey PH, Cradock MM, Anand KJS. Cognitive and behavioral outcomes of school-aged children who were born preterm: a meta-analysis. JAMA. 2002;288(6):728.
doi: 10.1001/jama.288.6.728 - Fraello D, Maller-Kesselman J, Vohr B, Katz KH, Kesler S, Schneider K, Reiss A, Ment L, Spann MN. Consequence of preterm birth in early adolescence: the role of language on auditory short-term memory. J Child Neurol. 2011;26(6):738-742.
doi: 10.1177/0883073810391904 - Никитин Ю.М., Труханов А.И. Ультразвуковая допплерографическая диагностика сосудистых заболеваний. М.: Видар; 1998.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
С целью снижения повреждающего воздействия гипоксии, коррекции тяжелых метаболических и кардиальных нарушений при развитии критического состояния у недоношенных новорожденных проведено изучение метаболической терапии цитофлавином у глубоконедоношенных детей (33 ребенка основной группы и 25 детей группы сравнения. Выявлено, что использование данного препарата у детей с экстремально низкой и очень низкой массой тела с постгипоксическими повреждениями миокарда и тяжелыми метаболическими нарушениями приводит к нормализации показателей кислотно-щелочного состояния в течение суток от начала лечения. На фоне терапии препаратом отмечен выраженный кардиоцитопротективный эффект, не наблюдается увеличения степени внутрижелудочковых кровоизлияний.
Ключевые слова: глубоконедоношенные новорожденные, постгипоксические повреждения миокарда, постгипоксические повреждения ЦНС, внутрижелудочковые кровоизлияния, кислотно-щелочное состояние, лактат, цитофлавин.
To reduce the damaging action of hypoxia and to correct severe metabolic and cardiac disorders in critically ill premature newborn infants, metabolic therapy with cytoflavin was studied in extremely premature infants (33 and 25 babies in a study group and a comparison one, respectively).
The use of this drug in extremely low and very low birthweight babies with posthypoxic myocardial damage and severe metabolic disorders was found to lead to normalization of acid-base balance within 24 hours after treatment initiation. During the therapy, there was a marked cardiocytoprotective effect and no increase in the degree of intragastric bleedings.
Key words: extremely premature newborn infants, posthypoxic myocardial damage, posthypoxic CNS damage, intragastric bleedings, acid-base balance, lactate, cytoflavin.
Среди этиологических факторов, наиболее значимых в патогенезе перинатальных церебральных повреждений у новорожденных, главная роль принадлежит гипоксии 1. Гипоксия плода развивается вследствие патологического течения беременности и приводит к рождению недоношенного ребенка с дыхательными нарушениями. Глубоконедоношенные новорожденные имеют ряд анатомо-физиологических особенностей, таких как гиперкатехоламинемия, рассыпной тип коронарных артерий и физиологическая карнитиновая недостаточность. Следствием чего являются резкое уменьшение образования макроэргов в митохондриях кардиомиоцитов, преобладание углеводного компонента обмена и запуск каскада нарушений. В результате гипоксии формируется респираторный ацидоз, в тканях вторично развиваются тканевая гипоксия и метаболический ацидоз.
Гиперкатехоламинемия первоначально оказывает стимулирующее воздействие на сосудодвигательный центр, отмечаются усиление сердечной деятельности, повышение тонуса артериол и тенденция к гипертензии. Постепенно возникает аритмия, снижается чувствительность адреналовых рецепторов к катехоламинам, нарастает сердечная недостаточность. Глубоконедоношенный новорожденный становится не способным адекватно пережить массивную перестройку кровообращения, что приводит к высокому функциональному напряжению сердечно-сосудистой системы, открытию фетальных коммуникаций; в результате присоединения метаболического ацидоза усугубляется нарушение кровообращения во всех тканях, возникают расстройства мозгового кровообращения и, как следствие, неблагоприятный неврологический исход.
Это обусловило поиск метода снижения повреждающего воздействия гипоксии и тяжести критического состояния у недоношенных новорожденных, нуждающихся в проведении реанимации и интенсивной терапии.
Использование ряда метаболических препаратов, привнесенных в неонатологию из взрослой практики (мексидол, инстенон и др.) и жизненно необходимых в ситуациях интенсивной терапии, имеет ограничения при применении у новорожденных
вследствие назначения препарата не в полном соответствии с инструкцией. В 2004–2009 гг. под руководством акад. РАМН проф. Н.Н. Володина проводилось многоцентровое двойное слепое рандомизированное исследование парентеральной формы препарата Цитофлавин (ООО «Научно-технологическая фармацевтическая фирма «ПОЛИСАН», Санкт-Петербург,
Россия) у недоношенных новорожденных с гипоксически-ишемическим поражением ЦНС различной степени тяжести 2. В связи с этим представляется важным дополнить данные исследования изучением состояния сердечно-сосудистой системы на фоне метаболической терапии цитофлавином.
Цель исследования: Проанализировать новые подходы к метаболической терапии у глубоконедоношенных детей в условиях отделения реанимации и интенсивной терапии новорожденных.
Характеристика детей и методы исследования Исследование проводилось в Президентском перинатальном центре Министерства здравоохранения и социального развития Чувашии. С целью коррекции тяжелых метаболических и кардиальных нарушений использовали цитофлавин внутривенно в дозе 2 мг/кг в сутки после разведения в 10% растворе глюкозы в соотношении 1:5. Препарат вводили в течение 5 сут, согласно рекомендациям для лечения недоношенных C.O. Рогаткина (2012). Скорость введения полученного раствора колебалась от 1 до 4 мл/ч.
В состав препарата входят сукцинат натрия, инозин, рибофлавин и никотинамид 3. Для изучения клинической эффективности цитофлавина с целью профилактики и лечения гипоксических повреждений головного мозга, ишемии миокарда и коррекции метаболических нарушений у недоношенных мы выделили группы недоношенных с длительными (более 48 ч) метаболическими нарушениями по данным кислотно-щелочного состояния (КЩС). У детей 1-й группы (основная группа, 33 ребенка) на фоне базисной интенсивной терапии вводился цитофлавин (разрешение этического комитета при ФГБОУ ВПО «Чувашский государственный университет имени И.Н. Ульянова» № 8 от 01 марта 2013 г.), во 2-й группе (группа сравнения, 25 детей) проводилась только базисная интенсивная терапия. Характеристика сравниваемых групп представлена в таблице.
Анализировали динамику показателей КЩС, электрокардиографии (ЭКГ), эхокардиографии (Эхо-КГ), неврологического статуса. Функциональные методы исследования выполнялись в отделении функциональной диагностики. Эхокардиография
проводились детям в 1, 2–4, 5–7-е сутки жизни аппаратом «ALOKA1700», «LOGIQ book XP» c микроконвексными датчиками с частотой сканирования 5 мГц. Стандартное ЭКГ-исследование – в 1–2, 10-е сутки жизни, далее по показаниям аппаратом HeartMirror3-IKO фирмы INNOMED (Япония). Нейросонография осуществлялась в 1, 2–4, 5–7-е сутки жизни.
В работе применены общепринятые в медицинских исследованиях методы статистического анализа, параметрические и непараметрические методы. Достоверность различий оценивалась по критериям Стьюдента, z-оценка c поправкой Йейтса, теснота связей между признаками определялась с помощью корреляционного анализа по Спирмену. Полученные результаты заносились в базу данных персонального компьютера IBM и обрабатывались с помощью лицензионного статистического программного пакета «Statistika 6.0» в среде Windows.
Результаты и обсуждение
Выявлено, что у пациентов основной группы на фоне терапии с первых часов лечения происходила быстрая нормализация показателей КЩС за счет устранения метаболического компонента смешанного ацидоза (–6,0±0,3 до –3,1±0,1 ммоль/л в 1-й группе и –5,7±0,2 до –5,0±0,2 ммоль/л во 2-й группе). Через 6–12 ч после начала лечения величина дефицита оснований (ВЕ) в группе детей, получавших метаболическую терапию, была достоверно меньше по сравнению с таковой в группе сравнения (–4,7±0,2 ммоль/л против –5,5±0,2 ммоль/л; р=0,001); в дальнейшем, к концу 2-х суток жизни показатели сохранялись в пределах нормальных значений до окончания 5-дневного курса терапии (–1,4±0,2 ммоль/л против –3,3±0,1 ммоль/л в группе сравнения; р=0,001).
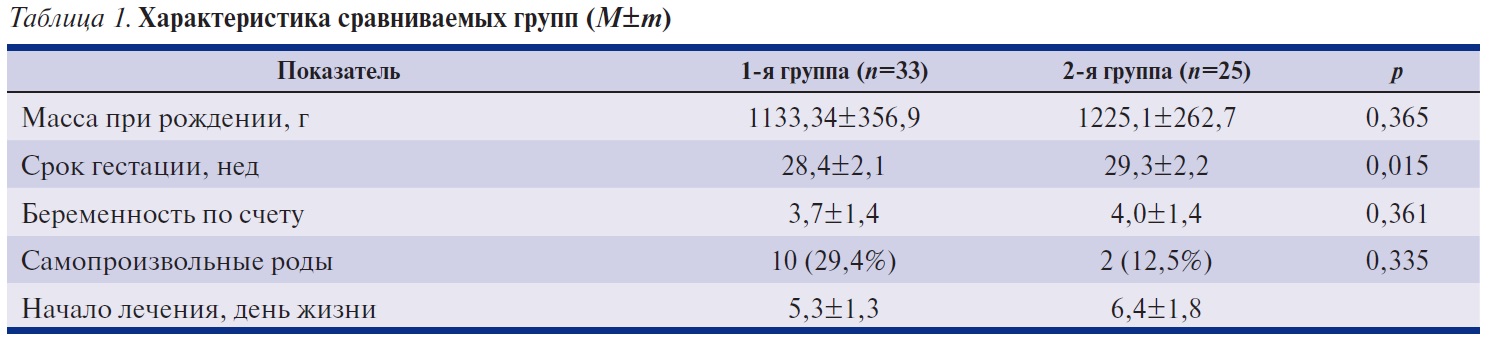
Помимо показателя ВЕ анализировали динамику содержания сывороточного лактата у детей сравниваемых групп (рис. 1). Исходный уровень лактата составлял 3,9±0,2 ммоль/л в 1-й группе пациентов и 3,7±0,2 ммоль/л во 2-й группе. Через 24 ч уровень лактата у детей 1-й группы не превышал нормальных значений (1,5±0,2 ммоль/л), в группе сравнения составлял 2,3±0,1 ммоль/л (р=0,001). Аналогичным образом представлена динамика показателей рН крови (рис. 2). Если в группе детей, получавших терапию цитофлавином, уже в начале 2-х суток от начала терапии были получены параметры рН, близкие к нормальным значениям (рН7,28), то в группе сравнения этого параметра удалось достичь в конце 2-х суток
от начала терапии (р=0,043). Динамика показателей осмолярности у детей сравниваемых групп представлена на рис. 3.
В течение первых часов лечения концентрацию O2 в дыхательной смеси у новорожденных основной группы удалось снизить до 32%, а затем и до 25%. Таким образом, уже к концу 1-х суток от начала терапии дети основной группы получали дыхательную смесь, содержащую нетоксичные концентрации кислорода. У детей 2-й группы концентрация O2 в дыхательной смеси была более высокой в начале терапии (45%), что диктовалось показателями КЩС и данными
транскутанного мониторинга SрO2. Несмотря на то, что концентрацию О2 в дыхательной смеси у детей группы сравнения пытались снижать, достичь безопасных его концентраций в этой группе удалось только к концу 2-х суток.
По данным ЭКГ выявлено, что в 1-е сутки жизни у всех пациентов отмечался синусовый ритм со средней частотой 145 в минуту, правограмма со средней величиной угла альфа от +95° до +158°, интервал P–Q составлял 0,08–0,10 с, длительность комплекса QRS – 0,04–0,06 с Патологические изменения комплекса QRST в виде низковольтажной ЭКГ, отра-
жающей снижение сократимости миокарда в зоне ишемии, наблюдались более чем у половины детей 1-й и 2-й групп (у 53 и у 51% соответственно). Глубокий патологический зубец Q продолжительностью более 0,03 мс и амплитудой более ¼ зубца R не менее чем в двух грудных отведениях у недоношенных детей был выявлен у 11,1% детей 1-й группы и у 10% – в группе сравнения.
С 3-го дня терапии, по данным ЭКГ, уменьшались признаки электрической нестабильности миокарда, энергетического дефицита, изменения реполяризации в обеих группах. Однако к 5-м суткам терапии темпы положительных ЭКГ-изменений в основной группе были более быстрыми и выраженными, чем в группе сравнения. При сходных данных ЭКГ к 5-м суткам терапии количество пациентов с сохраняющимися ST-депрессией и подъемом в правых и левых грудных отведениях превысило таковое в основной группе не менее чем в 2 раза (соответственно 39,6 и 13,9%; р=0,033 и 19,6 и 4,6%, р=0,1). У 15 (45,5%) детей 1-й группы и 4 (16%) детей 2-й группы в правых грудных отведениях зубец T был положительным
и изоэлектричным. У 33,3% пациентов 1-й группы уменьшилась ишемическая инверсия зубца Т, тогда как во 2-й группе она сохранялась в 80% наблюдений (p=0,0001). Зубец Т в левых грудных отведениях в основной группе изначально был положительным лишь в 30% случаев; на фоне лечения цитофлавином к 5-му дню терапии стал положительным у ¾ пациентов, а количество детей с инверсией зубца Т уменьшилось в 4 раза (с 26,6 до 6,66%; p=0,053).
Мы проанализировали состояние неврологического статуса новорожденных в динамике. Известно, что наиболее распространенными среди церебральных поражений у глубоконедоношенных новорожденных являютсявнутрижелудочковые кровоизлияния и перивентрикулярная лейкомаляция.
Внутрижелудочковые кровоизлияния чаще наблюдаются у недоношенных новорожденных как следствие незрелости сосудов герминативного матрикса и представляют серьезную опасность для недоношенных, так как являются одной из главных причин летальных исходов и тяжелых психоневрологических нарушений в дальнейшем. При нейросонографии у наблюдавшихся новорожденных двух групп была выявлена недостоверная разница в частоте и степени неврологических изменений. Частота внутрижелудочковых кровоизлияний 1-й степени была одинаковой в обеих группах (39 и 36% соответственно); внутрижелудочковые кровоизлияния 2-й степени были выявлены в 21,2 и 27,5% случаев соответственно (z=0,08, p=0,93); кровоизлияния 3-й степени наблюдались в 2 раза чаще у пациентов группы сравнения, но разница не была достоверной (5,8 и 10,1% пациентов соответственно, z=0,097, p=0,92). Отмечена недостоверная разница синдрома угнетения ЦНС у детей сравниваемых групп на 5-е сутки терапии, хотя этот синдром встречался в 2 раза реже в 1-й группе, чем во 2-й (4,3 и 9,5% пациентов соответственно; z=0,08, p=0,90).
На фоне терапии цитофлавином не отмечалось нарастания степени внутрижелудочкового кровоизлияния, а у пациентов 2-й группы (35,4%) наблюдалось сочетание перивентрикулярной лейкомаляции и внутрижелудочкового кровоизлияния на фоне глубокой незрелости головного мозга. Мы провели корреляционный анализ между степенью внутрижелудочкового кровоизлияния и проведенной терапией в сравниваемых группах и не выявили достоверной разницы
(в 1-й группе r=+0,12, p=0,12, во 2-й группе r=+0,19, p=0,15).
Выводы
Таким образом, использование Цитофлавина у детей с экстремально низкой и очень низкой массой тела с постгипоксическими повреждениями миокарда и тяжелыми метаболическими нарушениями приводит к нормализации показателей КЩС в течение суток от начала лечения (р=0,043), параметра ВЕ до –3,0±0,1 ммоль/л (р=0,001), уровня лактата до 1,5±0,2 ммоль/л (р=0,001) и выраженному кардиоцитопротективному эффекту.
Список литературы
1. Perlman J.M. Neurology: neonatology questions and controversies. Saunders, Elsevier, 2008; 225.
2. Володин Н.Н., Рогаткин С.О., Людовская Е.В. Лечение детей, перенесших перинатальную гипоксию в период ранней неонатальной адаптации. Вопр гинекол, акуш и перинатол 2005; 1: 20–25. (Volodin N.N., Rogatkin S.O., Ljudovskaja E.V. Treatment of children with perinatal hypoxia during the early neonatal adaptation. Vopr ginekol, akush i perinatol 2005; 1: 20–25.)
3. Рогаткин С.О. Диагностика, профилактика и лечение перинатальных постгипоксических поражений центральной нервной системы у ново рожденных и детей ран него возраст а. Автореф. дис. … докт. мед. наук. М 2012; 44. (Rogatkin S.O. Diagnosis, prevention and treatment of perinatal posthypoxic lesions of the central nervous system in children and new born his age and injuries. Avtoref. dis. … dokt. med. nauk. M 2012; 44.)
Источник публикации: Российский вестник перинатологии и педиатрии, 2, 2016
Материал предоставлен ООО «Полисан»
Источник
