Влияние гипофиза на развитие ребенка
Рост – это один из наиболее важных показателей здоровья ребенка.
Эта статья посвящена гипопитуитаризму – заболеванию эндокринной системы с изолированным дефицитом гормона роста (соматотропный гормон) или множественным дефицитом гормонов, которые вырабатывает гипофиз.
Важно знать причины, особенно, генетические механизмы развития заболевания, а также классификацию этой патологии, клиническая картина и ее варианты, диагностика и критерии направления к детскому эндокринологу, и необходимые обследования в рамках наблюдения ребенка с гипопитуитаризмом.
Что такое гипофиз и почему возникает гипопитуитаризм
Гипопитуитаризм – эндокринная патология, которая характеризуется снижением или полным отсутствием секреции одного (соматотропный или гормон роста) или более гормонов гипофиза.
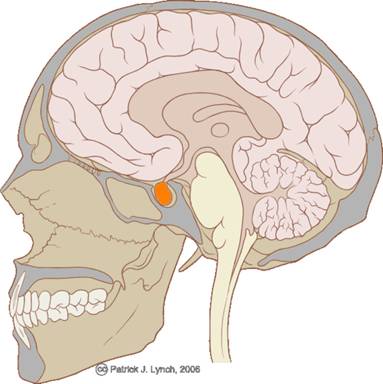
Гипофиз — это основная железа эндокринной системы, что входит в гипоталамо-гипофизарную систему, контролирующую функционирование периферийных эндокринных желез.
Этот термин от латинского слова hypophysis, что означает «отросток» и имеет следующие синонимические названия как «нижний придаток мозга» или «питуитарная железа».
Эта эндокринная железа расположена в центральной части головного мозга на турецком седле, хорошо защищена подкоркой правого и левого полушарий.
Какие гормоны продуцирует гипофиз
Гормоны выделяет передняя доля – аденогипофиз, задняя доля гипофиза выполняет нейроэндокринную функцию и участвует в стабилизации артериального давления и водно-солевого баланса. Промежуточная доля соединяет эти доли и является проводником сигналов от гипоталамуса.
Нарушения в строении или функционировании гипофиза вызывают патологические изменения в организме, связанные с недостатком продукции гормонов:
- соматотропный гормон (СТГ) – влияет на роста всех клеток организма, интеллектуальное и физиологическое развитие, обмен веществ;
- тиреотропный гормон (ТТГ) – активирует работу щитовидной железы и продукции ее гормонов, а также фосфолипидов и нуклеиновой кислоты;
- адренокортикотропный гормон (АКТГ) – активирует работу гормонов коры надпочечников (кортизола, кортизона и кортикостерона);
- гонадотропные гормоны (лютеинизирующий и фолликулостимулирующий гормон ЛГ и ФСГ) – стимуляторы секреции гормонов половыми железами;
- пролактин – гормон стимулирующий рост молочных желез, лактацию, регулирующий функцию половых желез (яичников или яичек) и иммунные процессы.
Гипопитуитаризм связан с недостатком продукции соматотропного гормона (изолированная соматотропная недостаточность) и других гормонов гипофиза (пангипопитуитаризм).
Возможно более позднее развитие дефицита других гормонов гипофиза через несколько лет после манифестации изолированной соматотропной недостаточности.
В связи с этим развиваются симптомы, которые характеризуют недостаток действия этих гормонов в организме – гипотиреоз, гипокортицизм, гипогонадизм (задержка или отсутствие полового созревания), несахарный диабет.
Причины
Выделяют врожденный гипопитуитаризм и приобретенный гипопитуитаризм.
Врожденный гипопитуитаризм может развиваться в результате:
- пренатальной и родовой травмы;
- внутриутробного поражения структур гипофиза – дефекты развития (гипоплазии или аплазии);
- мутациями в генах, контролирующих продукцию СТГ.
Помимо этого, врожденный гипопитуитаризм может являться составной частью врожденных «синдромов дефекта среднего мозга». Наиболее частой патологией в этой группе является септооптическая дисплазия, характеризующаяся агенезией/гипоплазией зрительных нервов, прозрачной перегородки и мозолистого тела, и разной степенью нарушения зрения.
Приобретенный гипопитуитаризм возникает:
- после травм головы;
- после хирургических вмешательств в связи с повреждением гипофизарной ножки;
- появления опухолей гипофизарно-гипоталамической области;
- при облучении головы и шеи (при лейкозе, лимфогранулематозе, ретинобластоме);
- после проведения химиотерапии;
- воспаления (энцефалит и менингит, аутоиммунный гипофизит);
- сосудистых патологий — аневризмы сосудов гипофиза, инфаркт гипофиза.
Наследственные формы гипопитуитаризма
Генетическая основа дефицита гормона роста при наличии родственников первой степени родства с той же патологией (с ростом ≤3 стандартных отклонений (SDS)).Они встречаются в 5—30% случаев.
Выделяют наследственный изолированный дефицит гормона роста (ИДГР) или множественный дефект гормонов аденогипофиза (МДГА)
Наследственный изолированный дефицит СТГ ассоциирован с 5 типами различных заболеваний:
- Тип 1А и 1В, которые наследуются по аутосомно-рецессивному типу – у каждого из родителей должен присутствовать соответствующий дефектный ген GH — I (грубые мутации или делеции).
- Тип II наследуется по аутосомно-доминантному типу – один из родителей болен ИДГР.
- Тип III – наследуется как сцепленный с Х – хромосомой и сочетается с гипоглобулинемиями.
Тип 1А протекает значительно тяжелее – отмечается выраженная задержка роста и тяжелый дефицит соматотропного гормона, у детей всегда возникают гипогликемические состояния.
При всех этих формах отмечаются низкие уровни продукции СТГ после проведения проб, для уточнения диагноза проводится молекулярно-генетическое обследование.
Заболевания, с множественным дефицитом гормонов аденогипофиза связаны с мутациями в генах, кодирующих гипофизарные транскрипционные факторы, участвующие в эмбриогенезе аденогипофиза. К данным генам относятся гены: POU1F1 (PIT-1), PROP-1, LHX-3, LHX-4, HESX-1, Pitx2
Большинство мутаций гена PIT-1, который регулирует развитие гипофиза в периоде эмбрионального развития, обнаруженных на сегодняшний день, имеют рецессивный характер наследования (т.е должны присутствовать у обеих родителей важный фактор – близкородственные браки. При этой генной мутации отмечается дефицит гормона роста и пролактина, с возможным снижением секреции гормонов щитовидной железы.
Ген PROP1 (prophet of Pit1) кодирует одноименный белок, который так же, как и PIT-1, является фактором транскрипции. Дефект данного гена является наиболее часто встречающейся генетической причиной при гипопитуитаризме (соматотропной недостаточности), к которой часто в течение жизни присоединяются гипогонадизм (нарушения полового созревания, чаще в подростковом возрасте) и гипокортицизм у подростков или даже после 20-30 лет жизни. Поэтому детей необходимо наблюдать длительно. Важно помнить, что в 20 % случаев при данной генетической патологии отмечается гиперплазия (увеличение) гипофиза при обследовании МРТ, которая проходит самостоятельно и не требует оперативного вмешательства. В настоящее время подобная МРТ-картина у ребенка любого возраста с дефицитом СТГ/Пролактина/ТТГ является показанием для молекулярной диагностики, в первую очередь, для анализа гена PROP-1.
Особенности приобретенных форм болезни
Особенностью приобретенной соматотропной недостаточности, вне зависимости от причин ее возникновения, является тот факт, что она в большинстве случаев сочетается с дефицитом других тропных гормонов (ТТГ, АКТГ, ЛГ и ФСГ), однако «выпадение» гипофизарных гормонов происходит не одновременно, а имеет определенную стадийность.
Вместе с тем секреция соматотропного гормона, являясь, по-видимому, наиболее чувствительной к действию повреждающего фактора, страдает в первую очередь. Гораздо реже развивается несахарный диабет (при поражении гипоталамических ядер или повреждении воронки гипофиза).
Главные причины:
- Опухоли гипоталамуса и гипофиза
(краниофарингиома, аденома гипофиза). - Опухоли других отделов мозга
(глиома зрительного нерва). - Травмы (черепно-мозговая травма, хирургическое повреждение ножки гипофиза).
- Инфекции (вирусный или бактериальный энцефалит и менингит, неспецифический гипофизит).
- Супраселлярные арахноидальные кисты, гидроцефалия, синдром «пустого турецкого седла»
- Сосудистая патология (аневризмы сосудов гипофиза, инфаркт гипофиза).
- Облучение головы и области шеи (лейкемия, ретинобластома, другие опухоли головы и шеи, общее облучение всего тела (например, пересадка костного мозга).
- Токсическое воздействие химиотерапии.
- Инфильтративные болезни (гистиоцитоз, саркоидоз).
врач-педиатр, детский эндокринолог Сазонова Ольга Ивановна
Источник
 Гипо́физ — мозговой придаток в форме округлого образования, расположенного на нижней поверхности головного мозга в костном кармане, называемом турецким седлом, вырабатывает гормоны, влияющие на рост, обмен веществ и репродуктивную функцию. Является центральным органом эндокринной системы.
Гипо́физ — мозговой придаток в форме округлого образования, расположенного на нижней поверхности головного мозга в костном кармане, называемом турецким седлом, вырабатывает гормоны, влияющие на рост, обмен веществ и репродуктивную функцию. Является центральным органом эндокринной системы.
Вес гипофиза составляет около 0,5—0,6 г., он состоит из двух крупных различных по происхождению и структуре долей: передней — аденогипофиза (составляет 70—80 % массы органа) и задней — нейрогипофиза. Вместе с нейросекреторными ядрами гипоталамуса гипофиз образует гипоталамо-гипофизарную систему, контролирующую деятельность периферических эндокринных желёз.
Закладка гипофиза происходит на 4—5 неделе эмбриогенеза. Передняя доля гипофиза развивается из эпителиального выпячивания дорсальной стенки ротовой бухты в виде пальцевидного выроста (кармана Ратке), направляющегося к основанию головного мозга, в области III желудочка, где встречается с будущей задней долей гипофиза, которая развивается позднее передней из отростка воронки промежуточного мозга.
Гипофиз тесным образом соединен с гипоталамусом — отделом мозга, играющим важнейшую роль в регуляции многих процессов в организме, в том числе в поддержании постоянства внутренней среды, терморегуляции, деятельности внутренних органов. Гипоталамус содержит как нервные клетки, участвующие в деятельности вегетативной нервной системы (регулирующей многие функции внутренних органов), так и секреторные клетки, которые вырабатывают так называемые рилизинг-гормоны. Эти гормоны призваны оказывать строго специфическое воздействие на гипофиз, побуждая его повышать или снижать выработку тех или иных гормонов в зависимости от потребностей организма.
Гипофиз ребенка при рождении имеет массу около 0,12 г. Его рост и функциональное развитие продолжается до 20-летнего возраста. А поскольку гипофиз является регулятором деятельности всех остальных желез внутренней секреции, то его функциональная незрелость обусловливает некоторую нестабильность всей эндокринной системы ребенка. Одним из гормонов выделяемых гипофизом является соматотропин, который называют гормоном роста за то, что у детей и подростков, а также молодых людей с ещё не закрывшимися зонами роста в костях он вызывает выраженное ускорение линейного (в длину) роста, в основном за счет роста длинных трубчатых костей конечностей. Соматотропин оказывает мощное анаболическое и анти-катаболическое действие, усиливает синтез белка и тормозит его распад, а также способствует снижению отложения подкожного жира, усилению сгорания жира и увеличению соотношения мышечной массы к жировой. Кроме того, соматотропин принимает участие в регуляции углеводного обмена — он вызывает выраженное повышение уровня глюкозы в крови и является одним из антагонистов инсулина по действию на углеводный обмен. Описано также его действие на островковые клетки поджелудочной железы, иммуностимулирующий эффект, усиление поглощения кальция костной тканью и др. Многие эффекты гормон роста вызывает непосредственно, но значительная часть его эффектов опосредуется инсулиноподобными факторами роста, который вырабатывается под действием гормона роста в печени и стимулирует рост большинства внутренних органов.
Получить выполненную работу или консультацию специалиста по вашему
учебному проекту
Узнать стоимость
Источник
Ãèïîôèç ÿâëÿåòñÿ âàæíåéøåé æåëåçîé âíóòðåííåé ñåêðåöèè, ïîääåðæèâàþùåé íåïîñðåäñòâåííóþ ñâÿçü ñ íåðâíîé ñèñòåìîé (íåéðîýíäîêðèííàÿ ñèñòåìà), ðàñïîëàãàåòñÿ â ÿìêå òóðåöêîãî ñåäëà íà îñíîâàíèè ìîçãà. Ìàññà ãèïîôèçà 0,50,7 ã.
 ãèïîôèçå âûäåëÿþò äâå äîëè, èìåþùèå ðàçëè÷íîå ïðîèñõîæäåíèå è çíà÷åíèå. Ïåðåäíÿÿ äîëÿ ãèïîôèçà (àäåíîãèïîôèç) ðàçâèâàåòñÿ èç ýêòîäåðìû ýïèòåëèÿ ðîòîâîé áóõòû. Îíà êðóïíåå äðóãèõ äîëåé è ñîñòîèò èç òðåõ ÷àñòåé: äèñòàëüíîé, áóãîðíîé è ïðîìåæóòî÷íîé. Çàäíÿÿ äîëÿ ãèïîôèçà (íåéðîãèïîôèç) ðàçâèâàåòñÿ èç âûðîñòà íèæíåé ïîâåðõíîñòè âòîðîãî ìîçãîâîãî ïóçûðÿ áóäóùåãî ïðîìåæóòî÷íîãî ìîçãà. Ó çàäíåé äîëè ðàçëè÷àþò íåðâíóþ ÷àñòü, ðàñïîëîæåííóþ ïîçàäè ïðîìåæóòî÷íîé ÷àñòè àäåíîãèïîôèçà, è âîðîíêó, ñîåäèíÿþùóþ íåðâíóþ ÷àñòü ñ ãèïîòàëàìóñîì ïðîìåæóòî÷íîãî ìîçãà.
Ïåðåäíÿÿ äîëÿ ãèïîôèçà, åå äèñòàëüíàÿ (ãëàâíàÿ) ÷àñòü, îáðàçîâàíà ýïèòåëèàëüíûìè æåëåçèñòûìè êëåòêàìè (àäåíîöèòàìè), êîòîðûå ôîðìèðóþò òÿæè (ïåðåêëàäèíû), ìåæäó êîòîðûìè ðàñïîëàãàþòñÿ êðîâåíîñíûå ñîñóäû.  æåëåçèñòîé òêàíè ðàçëè÷àþò íåñêîëüêî âèäîâ êëåòîê: (1) îäíè èç íèõ (àäåíîöèòû) âûäåëÿþò ãîðìîí ðîñòà; (2) äðóãèå ïðîëàêòèí, èìåþùèé îòíîøåíèå ê ôóíêöèè ìîëî÷íîé æåëåçû; (3) ÷àñòü êëåòîê âûäåëÿåò ãîíàäîòðîïíûé ãîðìîí ôàëëîòðîïèí (ëþòðîïèí), òåñíî ñâÿçàííûé ñ îáðàçîâàíèåì æåëòîãî òåëà â ïîëîâûõ êëåòêàõ; (4) äðóãèå êëåòêè ïðîäóöèðóþò òèðîòðîïèí, îêàçûâàþùèé âëèÿíèå íà ñîñòîÿíèå ùèòîâèäíîé æåëåçû; (5) êîðòèêîòðîïíûå ýíäîêðèíîöèòû àäåíîãèïîôèçà âûäåëÿþò àäåíîêîðòèêîòðîïíûé ãîðìîí (ÀÊÒÃ), èëè êîðòèêîòðîïèí.
Ïðîìåæóòî÷íàÿ ÷àñòü ðàñïîëàãàåòñÿ ìåæäó ïåðåäíåé è çàäíåé ÷àñòÿìè ãèïîôèçà, ïðåäñòàâëÿåò ñîáîé óçêóþ ïîëîñêó æåëåçèñòîãî âåùåñòâà, ýíäîêðèíîöèòû êîòîðîãî ñèíòåçèðóþò ìåëàíîöèòîòðîïèí, âëèÿþùèé íàîáìåí ïèãìåíòà ìåëàíèíà, à òàêæå ãîðìîí ëèïîòðîïèí, ñòèìóëèðóþùèé æèðîâîé îáìåí.
Çàäíÿÿ äîëÿ ãèïîôèçà íå ñèíòåçèðóåò ñîáñòâåííûõ ãîðìîíîâ, à îñóùåñòâëÿåò âûäåëåíèå â êðîâü áèîëîãè÷åñêè àêòèâíûõ âåùåñòâ, îáðàçóþùèõñÿ â íåéðîñåêðåòîðíûõ ÿäðàõ ãèïîòàëàìóñà è ïîñòóïàþùèõ â ãèïîôèç ïî íåðâíûì âîëîêíàì ãèïîòàëàìî-ãèïîôèçàðíîãî òðàêòà (äâóõñòîðîííÿÿ ñâÿçü ìåæäó ãèïîôèçîì è ãèïîòàëàìóñîì). Ãîðìîíû îêñèòîöèí è âàçîïðåññèí (àíòèäèóðåòè÷åñêèé ãîðìîí) âûðàáàòûâàþòñÿ íåéðîñåêðåòîðíûìè êëåòêàìè ñóïðàîïòè÷åñêîãî (íàäãëàçíè÷íîãî) è ïàðàâåíòðèêóëÿðíîãî (îêîëîÿäåðíîãî) ÿäåð ãèïîòàëàìóñà. Ýòè ãîðìîíû ïî äëèííûì âîëîêíàì ïîñòóïàþò èç ãèïîòàëàìóñà â ãèïîôèç, ãäå íàêàïëèâàþòñÿ è ïîñòóïàþò â êðîâü. Âàçîïðåññèí, èëè àíòèäèóðåòè÷åñêèé ãîðìîí (ÀÄÃ), ñïîñîáñòâóþò ðåàáñîðáöèè âîäû èç ïåðâè÷íîé ìî÷è â êàíàëüöàõ íåôðîíîâ ïî÷åê. Ïðè íåäîñòàòêå âàçîïðåññèíà â ñâÿçè ñ íàðóøåíèåì íåéðîñåêðåòîðíîé ôóíêöèè ÿäåð ãèïîòàëàìóñà èëè ñíèæåíèåì ôóíêöèè çàäíåé äîëè ãèïîôèçà èç îðãàíèçìà âûâîäèòñÿ î÷åíü áîëüøîå êîëè÷åñòâî íå ñîäåðæàùåé ñàõàðà ìî÷è è âîçíèêàåò î÷åíü ñèëüíàÿ æàæäà. Ýòî ñîñòîÿíèå íàçûâàåòñÿ íåñàõàðíûì ìî÷åèçíóðåíèåì (íåñàõàðíûé äèàáåò). Îêñèòîöèí ñòèìóëèðóåò ñîêðàùåíèå ìèîìåòðèÿ (ãëàäêîé ìóñêóëàòóðû ìàòêè) â ïåðèîä ðîäîâ.
Òàêèì îáðàçîì, ãîð ìîíîîáðàçóþùàÿ ôóíêöèÿ âñåãî ãèïîôèçà íàõîäèòñÿ ïîä êîíòðîëåì è âî âçàèìîäåéñòâèè ñ ãèïîòàëàìóñîì. Ãèïîôèç íå òîëüêî ñèíòåçèðóåò è âûäåëÿåò â êðîâü ìíîãî÷èñëåííûå ãîðìîíû, íî è ðåãóëèðóåò âíóòðèñåêðåòîðíóþ àêòèâíîñòü äðóãèõ æåëåç, âëèÿåò íà îáìåííûå ïðîöåññû âñåãî îðãàíèçìà.
Òàê, ñîìàòîòðîïíûé («ñîìà» òåëî) ãîðìîí ãèïîôèçà âëèÿåò íà áåëêîâûé, óãëåâîäíûé, æèðîâîé îáìåí, ðåãóëèðóåò ðîñò. Ïðè èçáûòî÷íîé ïðîäóêöèè ýòîãî ãîðìîíà â äåòñêîì è ïîäðîñòêîâîì âîçðàñòå ôîðìèðóåòñÿ î÷åíü âûñîêèé ðîñò ãèãàíòèçì (2 ìåòðà è áîëåå). Óñèëåíèå ýòîãî ãîðìîíà â ñòàð÷åñêîì âîçðàñòå âûçûâàåò ðàçðàñòàíèå êðàéíèõ ÷àñòåé òåëà (íîñà, ïîäáîðîäêà, êèñòåé ðóê è ñòîïû íîã), ÷òî ïîëó÷èëî íàçâàíèå àêðîìåãàëèÿ. Íåäîñòàòîê ñîìàòîòðîïíîãî ãîðìîíà â ðàííåì âîçðàñòå çàìåäëÿåò ðîñò ÷åëîâåêà, îí îñòàåòñÿ êàðëèêîì (ðîñò ìåíåå 125 ñì). Íàðóøåíèå îáìåííûõ ïðîöåññîâ ïðè ãèïåðôóíêöèè ãèïîôèçà ñ íàðóøåíèåì æèðîâîãî îáìåíà ïðèâîäèò ê ãèïîôèçàðíîìó îæèðåíèþ (áîëåçíü Èöåíêî-Êóøèíãà), ïðè ãèïîôóíêöèè æèðîâîãî îáìåíà ãèïîôèçàðíàÿ êàõåêñèÿ.
Ãîíàäîòðîïíûå ãîðìîíû ãèïîôèçà (ôîëëèêóëîñòèìóëèðóþùèé ôîëëèòðîïèí, ëþòåèíèçèðóþùèé ëþòðîïèí, ëàêòîãåííûé ïðîëàêòèí) ñòèìóëèðóþò ôóíêöèþ ïîëîâûõ æåëåç. Ôîëëèòðîïèí âëèÿåò íà ðàçâèòèå è ñîçðåâàíèå â ÿè÷íèêàõ ôîëëèêóëîâ, à â ìóæñêîì îðãàíèçìå íà îáðàçîâàíèå ñïåðìàòîçîèäîâ è ðàçâèòèå ïðåäñòàòåëüíîé æåëåçû. Ëþòðîïèí ñòèìóëèðóåò â ÿè÷íèêàõ è ÿè÷êàõ ôóíêöèè ýíäîêðèíîöèòîâ (âíóòðèñåêðåòîðíûõ êëåòîê) è ñåêðåöèþ èìè ïîëîâûõ ãîðìîíîâ (ýñòðîãåíîâ, àíäðîãåíîâ,). Ïðîëàêòèí ñòèìóëèðóåò ïðîäóêöèþ ïðîãåñòåðîíà â æåëòîì òåëå ÿè÷íèêà è ëàêòàöèþ (ïðîäóêöèþ ìîëîêà).
Àäåíîêîðòèêîòðîïíûé ãîðìîí (ÀÊÒÃ), èëè êîðòèêîòðîïèí, ñòèìóëèðóåò ôóíêöèþ êëåòîê êîðêîâîãî âåùåñòâà íàäïî÷å÷íèêîâ, âûäåëåíèþ êîðòèêîñòåðîèäîâ. Ñåêðåöèÿ è ñòèìóëÿöèÿ äåéñòâèÿ ÀÊÒà óñèëèâàåòñÿ ïðè ïîâûøåííûõ ýìîöèîíàëüíûõ ñîñòîÿíèÿõ (ñòðåññàõ), ÷òî ïðèâîäèò ê ñóæåíèþ àðòåðèàëüíûõ ñîñóäîâ è ïîâûøåíèþ àðòåðèàëüíîãî äàâëåíèÿ.
Òèðåîòðîïíûé ãîðìîí (òèðîòðîïèí) ñòèìóëèðóåò ôóíêöèþ ùèòîâèäíîé æåëåçû, ñåêðåöèþ åå ãîðìîíîâ. Ïðè äåéñòâèè òèðåîòðîïíîãî ãîðìîíà óâåëè÷èâàåòñÿ íå òîëüêî ñåêðåòîðíàÿ àêòèâíîñòü ùèòîâèäíîé æåëåçû, íî è êîëè÷åñòâî åå ñåêðåòîðíûõ êëåòîê. Ñåêðåöèÿ òèðåîòðîïíîãî ãîðìîíà ãèïîôèçà çàâèñèò îò óðîâíÿ ñîäåðæàíèÿ â êðîâè ãîðìîíîâ ùèòîâèäíîé æåëåçû. Âçàèìîîòíîøåíèÿ ãèïîôèçà è ùèòîâèäíîé æåëåçû ñòðîÿòñÿ ïî ïðèíöèïó îáðàòíîé ñâÿçè, ò. å. ïðè ïîâûøåíèè â êðîâè êîëè÷åñòâà ãîðìîíà ùèòîâèäíîé æåëåçû (òèðîêñèíà) ïðîäóêöèÿ òèðåîòðîïíîãî ãîðìîíà â ãèïîôèçå óìåíüøàåòñÿ. Ïðè óìåíüøåíèè ñîäåðæàíèÿ â êðîâè òèðîêñèíà è äðóãèõ ãîðìîíîâ ùèòîâèäíîé æåëåçû ñåêðåöèÿ òèðåîòðîïèíà óâåëè÷èâàåòñÿ.
Источник
Гипофиз имеет эктодермальное происхождение. Передняя и средняя (промежуточная) доли формируются из эпителия ротовой полости, нейрогипофиз (задняя доля) — из промежуточного мозга. У детей передняя и средняя доли разделены щелью, со временем она зарастает и обе доли тесно прилегают друг к другу.
Эндокринные клетки передней доли дифференцируются в эмбриональном периоде, и на 7—9-й неделе они уже способны к синтезу гормонов.
Масса гипофиза новорожденных составляет 100—150 мг, а размер 2,5—3 мм. На втором году жизни он начинает увеличиваться, особенно в возрасте 4—5 лет. После этого до 11 лет рост гипофиза замедляется, а с 11 лет вновь ускоряется. К периоду полового созревания масса гипофиза в среднем составляет 200—350 мг, к 18—20 годам — 500-600 мг. Диаметр гипофиза к совершеннолетию достигает 10-15 мм.
В передней доле гипофиза синтезируются гормоны, контролирующие функцию периферических эндокринных желез: тиреотропный, гонадотропные, адренокортикотропный, а также соматотропный гормон (гормон роста) и пролактин. Функциональная активность аденогипофиза полностью регулируется нейрогормонами, он не получает нервных влияний ЦНС.
Соматотропный гормон (соматотропин, гормон роста) — СТГ определяет ростовые процессы в организме. Его образование регулируется гипоталамическим СТГ-рилизинг-фактором. На этот процесс влияют также гормоны поджелудочной и щитовидной желез, гормоны надпочечников. К факторам, повышающим секрецию СТГ, относятся гипогликемия (понижение уровня глюкозы в крови), голодание, отдельные виды стресса, интенсивная физическая работа. Гормон выделяется также во время глубокого сна. Кроме того, гипофиз эпизодически секретирует большие количества СТГ в отсутствие стимуляции. Биологический эффект СТГ опосредован соматомедином, образующимся в печени. Рецепторы СТГ (т.е. структуры, с которыми гормон непосредственно взаимодействует) встроены в мембраны клеток. Основная роль СТГ — стимуляция соматического роста. С его активностью связаны рост костной системы, увеличение размеров и массы органов и тканей, белковый, углеводный и жировой обмен. СТГ действует иа многие железы внутренней секреции, почки, на функции иммунной системы. Как стимулятор роста на уровне тканей СТГ ускоряет рост и деление хрящевых клеток, образование костной ткани, способствует формированию новых капилляров, стимулирует рост эпифизарных хрящей. Последующую замену хрящей костной тканью обеспечивают тиреоидные гормоны. Оба процесса ускоряются под влиянием андрогенов, СТГ стимулирует синтез РНК и белков, а также деление клеток. Имеются половые различия в содержании СТГ и показателях развития мускулатуры, костной системы и жироотложения. Избыточное количество СТГ нарушает углеводный обмен, снижая использование глюкозы периферическими тканями, и способствует развитию сахарного диабета. Как и другие гипофизарные гормоны, СТГ способствует быстрой мобилизации жира из депо и поступлению в кровь энергетического материала. Кроме того, может происходить задержка внеклеточной воды, калия и натрия, возможно также нарушение обмена кальция. Избыток гормона приводит к гигантизму (рис. 3.20). При этом ускоряется рост костей скелета, однако по вышение секреции половых гормонов при достижении половой зрелости останавливает его. Повышенная секреция СТГ возможна и у взрослых. В этом случае наблюдается рост оконечностей тела (ушей, носа, подбородка, зубов, пальцев и др.). могут образовываться костные наросты, а также увеличиваться размеры органа пищеварения (язык, желудок, кишечник). Такая патология называется акромегалией и часто сопровождается развитием диабета.
Дети с недостаточным выделением гормона роста развиваются в карликов «нормального» телосложения (рис. 3.21). Задержка роста проявляется после 2 лет, но интеллектуальное развитие при этом обычно не нарушается.
Гормон определяется в гипофизе 9-недельного плода. В дальнейшем количество СТГ в гипофизе растет и к концу внутриутробного периода увеличивается в 12000 раз. В крови СТГ появляется на 12-й неделе внутриутробного развития, а у 5—8-месячных плодов его примерно в 100 раз больше, чем у взрослых. Концентрация СТГ в крови детей продолжает оставаться высокой, хотя в течение первой недели после рождения она снижается более чем на 50%. К 3—5 годам жизни уровень СТГ такой же, как у взрослых. У новорожденных СТГ участвует в иммунологической защите организма, оказывая влияние на лимфоциты.
СТГ обеспечивает нормальное физическое развитие ребенка. В физиологических условиях секреция гормона носит эпизодический характер. У детей СТГ секретируется 3—4 раза в течение дня. Общее его количество, выделяющееся во время глубокого ночного сна, значительно больше, чем у взрослых. В связи с этим фактом становится очевидной необходимость полноценного сна для нормального развития детей. С возрастом секреция СТГ уменьшается.
Скорость роста в пренатальном периоде в несколько раз больше, чем в постнатальном, однако влияние на этот процесс эндокринных желез не имеет решающего значения. Полагают, что рост плода находится в основном под влиянием плацентарных гормонов, факторов материнского организма и зави сит от генетической программы развития. Прекращение роста наступает, вероятно, потому, что изменяется общая гормональная ситуация в связи с достижением половой зрелости: эстрогены снижают активность СТГ.
Тиреотропный гормон (ТТГ) регулирует активность щитовидной железы в соответствии с потребностями организма. Механизм влияния ТТГ на щитовидную железу до сих пор до конца не выяснен, но его введение увеличивает массу органа и повышает секрецию тиреоидных гормонов. Действие ТТГ на белковый, жировой, углеводный, минеральный и водный обмен осуществляется через тиреоидные гормоны.
Клетки, продуцирующие ТТГ, появляются у 8-недельных эмбрионов. В течение всего внутриутробного периода абсолютное содержание ТТГ в гипофизе растет и у 4-месячного плода оно в 3—5 раз больше, чем у взрослых. Этот уровень сохраняется до рождения. На щитовидную железу плода ТТГ начинает влиять со второй трети беременности. однако зависимость функции щитовидной железы от ТТГ у плода выражена меньше, чем у взрослых. Связь гипоталамус — гипофиз устанавливается только на последних месяцах внутриутробного развития.
В первый год жизни ребенка концентрация ТТГ в гипофизе растет. Значительное увеличение синтеза и секреции наблюдается дважды: сразу после рождения и в период, предшествующий половому созреванию (препубертатный). Первое увеличение секреции ТТГ связывают с адаптацией новорожденных к условиям существования, второе соответствует гормональной перестройке, включающей усиление функции половых желез. Максимум секреции гормона достигается в возрасте от 21 года до 30 лет, в 51—85 лет ее величина уменьшается вдвое.
Адренокортикотропный гормон (АКТГ) действует на организм опосредованно, стимулируя секрецию гормонов надпочечников. Кроме того, АКТГ обладает прямой меланоцито-стимулирующей и липолитической активностью, поэтому повышение или понижение секреции АКТГ у детей сопровождается сложными нарушениями функций многих органов и систем.
При усиленной секреции АКТГ (болезнь Иценко—Кушинга) наблюдаются задержка роста, ожирение (отложение жира преимущественно на туловище), лунообразное лицо, преждевременное развитие волос на лобке, остеопороз, гипертония, диабет, трофические нарушения кожи (полосы растяжения). При недостаточной секреции АКТГ выявляются изменения, характерные для недостатка глюкокортикоидов.
Во внутриутробном периоде секреция АКТГ у зародыша начинается с 9-й недели, а на 7-м месяце его содержание в гипофизе достигает высокого уровня. В этот период надпочечники плода реагируют на АКТГ — в них увеличивается скорость образования годрокортизона и тестостерона. Во второй половине внутриутробного развития начинают действовать не только прямые, но и обратные связи между гипофизом и надпочечниками плода У новорожденных функционируют все звенья системы гипоталамус — гипофиз — кора надпочечников С первых часов после рождения дети уже реагируют на стрессовые раздражители (связанные, например, с затяжными родами, оперативными вмешательствами и др.) повышением содержания кортикостостероидов в моче Эти реакции, однако, выражены слабее, чем у взрослых, в связи с низкой чувствительностью гипотадамическкх структур к изменениям во внутренней и внешней среде организма. Усиливается влияние ядер гипоталамуса на функцию аденогипофиза. что в условиях стресса сопровождается увеличением секреции АКТГ. В старости чувствительность ядер гипоталамуса вновь падает, с чем связана меньшая выраженность в пожилом возрасте адаптационного синдрома.
Гонадотропными (гонадотропинами) называются фолликулостимулирующий и лютеинизирующий гормоны
Фолликулостимулирующий гормон (ФСГ) в женском организме вызывает рост фолликулов яичника, способствует образованию в иих эстрогенов. В мужском организме он влияет на сперматогенез в семенниках. Выделение ФСГ зависит от пата и возраста
Лютеинизирующий гормон (Л Г) вызывает овуляцию, способствует образованию желтого тела в яичниках женского организма, а в мужском организме стимулирует рост семенных пузырьков и предстательной железы, а также выработку андрогенов в семенниках.
Клетки, вырабатывающие ФСГ и ЛГ, развиваются в гипофизе к 8-й неделе внутриутробного развития, тогда же в них появляется ЛГ. а на 10-й неделе — ФСГ. В крови зародыша гонадотропны появляются с 3-месячного возраста. В крови плодов женского пола, особенно в последней трети внутриутробного развития, их концентрация выше, чем у мужского пола Максимальная концентрация обоих гормонов приходится на период 4.5—6.5 месяцев пренатального периода Значение этого факта до сих пор до конца не выяснено
Гонадотропные гормоны стимулируют эндокринную секрецию половых желез плода, но не контролируют их половую дифференцировку Во второй половине внутриутробного периода формируется связь между гипоталамусом, гонадотропной функцией гипофиза и гормонами половых желез. Это происходит после дифференцировки пола плода под действием тестостерона.
У новорожденных концентрация ЛГ в крови очень высока, но в течение первой недели после рождения она снижается и до 7—8-летнего возраста остается низкой. В пубертатном периоде увеличивается секреция гонадотропинов, к 14 годам она возрастает в 2—2,5 раза. У девочек гонадотропные гормоны вызывают рост и развитие яичников, появляется цикличность секреции ФСГ и ЛГ, что является причиной начала новых половых циклов. К 18 годам показатели ФСГ и ЛГ достигают взрослых значений.
Пролактин, или лютеотропный гормон (ЛТП. стимулирует функцию желтого тела и способствует лактации, т.е. образованию и секреции молока. Регуляция образования гормона осуществляется пролактин-ингибирующим фактором гипоталамуса, эстрогенами и тиреотропин-рилизинг-гормоном (ТРГ) гипоталамуса. Последние два гормона оказывают стимулирующее действие на секрецию гормона Повышение концентрации пролактина приводит к усилению выделения дофамина клетками гипоталамуса, который тормозит секрецию гормона. Этот механизм работает в период отсутствия лактации избыток дофамина угнетает активность клеток, образующих пролактин.
Секреция пролактина начинается с 4-го месяца внутриутробного развития и значительно усиливается в последние месяцы беременности Считается, что он участвует и регуляции обмена веществ у плода. В конце беременности уровень пролактина становится высоким как в крови матери, так и в амниотической жидкости. У новорожденных концентрация пролактина в крови высокая. Она снижается в течение первого года жизни. а во время полового созревания возрастает. причем у девочек сильнее, чем у мальчиков. У мальчиков-подростков пролактин стимулирует рост предстательной железы и семенных пузырьков.
Средняя доля гипофиза влияет на процессы гормонообразования аденогипофиза. Она участвует в секреции меланостимулирующего гормона (МСГ) (меланотропина) и АКТГ. МСГ имеет значение для пигментации кожи и волос. В крови беременных женщин его содержание повышено, в связи с чем на коже появляются пигментные пятна У плодов гормон на чинает синтезироваться на 10—11-й неделе. но его функция в развитии до сих пор окончательно не ясна.
Задняя доля гипофиза вместе с гипоталамусам в функциональном отношении составляет единое целое Гормоны, синтезированные в ядрах гипоталамуса, — вазопрессин и окситоцин — транспортируются в заднюю долю гипофиза и здесь хранятся до выделения в кровь
Вазопрессин, или антидиуретический гормон (АДГ). Органом-мишенью АДГ служат почки. Эпителий собирательных трубочек почек становится проницаемым для воды только под действием АДГ. что обеспечивает пассивную реабсорбцию воды. В условиях повышенной концентрации солей в крови повышается концентрация АДГ и, как следствие, моча становится более концентрированной, а потеря воды минимальной. При понижении концентрации солей в крови секреция АДГ уменьшается. Употребление алкоголя еще сильнее снижает секрецию АДГ, чем объясняется значительный диурез после приема жидкости вместе с алкоголем.
При введении больших количеств АДГ в кровь отчетливо выражено сужение артерий за счет стимуляции этим гормоном гладкой мускулатуры сосудов, в результате чего повышается кровяное давление (вазопрессорное действие гормона). Резкое падение кровяного давления при кровопотере или шоке резко увеличивает секрецию АДГ. Вследствие чего кровяное давление повышается. Заболевание, возникающее при нарушении секреции АДГ. называется несахарным диабетом. При этом образуется большое количество мочи с нормальным содержанием сахара в ней
Антидиуретическнй гормон гипофиза начинает выделяться на 4-м месяце эмбрионального развития, максимум его выделения приходится на конец первого года жизни, затем антидиуретическая активность нейрогипофиза начинает падать до довольно низких величин, и в возрасте 55 лет она примерно в 2 раза меньше, чем у годовалого ребенка.
Органом-мишенью для окситоцина служат мышечный слой матки и миоэпителиальные клетки молочной железы. В физиологических условиях молочные железы начинают выделять молоко в первые сутки после родов, и в это время младенец уже может сосать. Акт сосания служит сильным стимулом для тактильных рецепторов соска. От этих рецепторов по нервным путям импульсы передаются в нейроны гипоталамуса, которые являются одновременно и секреторными клетками, вырабатывающими окситоцин Последний с кровью переносится к миоэпителиальным клеткам. выстилающим молочную железу. Миоэпителиальные клетки располагаются вокруг альвеол железы, и при сокращении молоко выдавливается в про токи. Таким образом, для извлечения молока из железы от младенца не требуется активного сосания, поскольку ему помогает рефлекс «выделения молока.
С окситоцином связана и активация родовой деятельности. При механическом раздражении родовых путей нервные импульсы, которые поступают к нейросекреторным клеткам гипоталамуса, вызывают выделение в кровь окситоцина. К концу беременности под действием женских половых гормонов эстрогенов резко повышается чувствительность мышц матки (миометрия) к окситоцину. В начале родовой деятельности секреция окситоцина повышается, что вызывает слабые сокращения матки, проталкивающей плод в направлении шейки и влагалища Растяжение этих тканей является причиной возбуждения многочисленных механорецепторов в них. От которых сигнал передается в гипоталамус. Нейросекреторные метки гипоталамуса отвечают высвобождением новых порций окситоцина, благодаря чему сокращения матки усиливаются. В конечном итоге этот процесс переходит в роды, в ходе которых плод и плацента изгоняются. После изгнания плода раздражение механорецепторов и выброс окситоцина прекращаются.
Синтез гормонов задней доли гипофиза начинается в ядрах гипоталамуса на 3—4-м месяце внутриутробного периода, а на 4—5-м месяце они обнаруживаются в гипофизе. Содержание этих гормонов в гипофизе и их концентрация в крови постепенно увеличиваются к моменту рождения ребенка. У детей первых месяцев жизни антидиуретическое действие вазопрессина не играет существенной роли, лишь с возрастом его значение в удержании воды в организме увеличивается. У детей проявляется лишь антидиуретическое действие окситоцина, другие его функции выражены слабо. Матка и молочные железы начинают реагировать на окситоцин только после завершения периода полового созревания, т е после продолжительного действия на матку половых гормонов эстрогенов и прогестерона, а на молочную железу — гормона гипофиза пролактина.
Источник
